"정확한 규정 숙지 원활한 의사소통 중요"
라벨링·Claim 문구 주의, 제약수준 생산시설 감사도 대비해야
미국 OTC Drug 제도 A to Z
[CMN 박일우 기자] 중국발 특수가 끝을 보이면서 세계 최대시장 미국을 집중 겨냥하는 화장품업체가 부쩍 늘어나는 추세다.
중국의 위생허가처럼 미국에서도 넘어야할 장벽이 있다. 바로 OTC Drug 제도인데, 지난해초 잘 나가는 국내 기업 몇 곳이 이 OTC 문제로 수출에 어려움을 겪었을 만큼 아직 우리에게 익숙하지 않다.
최근 흐름을 보면 우리 기업이 미국에 판매하기 위해 자외선차단 제품을 OTC Drug에 등록할 경우 FDA로부터 제조소 감사를 받게 된다. 올해에도 벌써 3개 이상의 국내 기업이 FDA 감사를 받았다.
CMN은 대한화장품협회의 도움을 받아 미국 화장품제도의 핵심 중 하나인 OTC Drug 제도를 심층 분석했다.
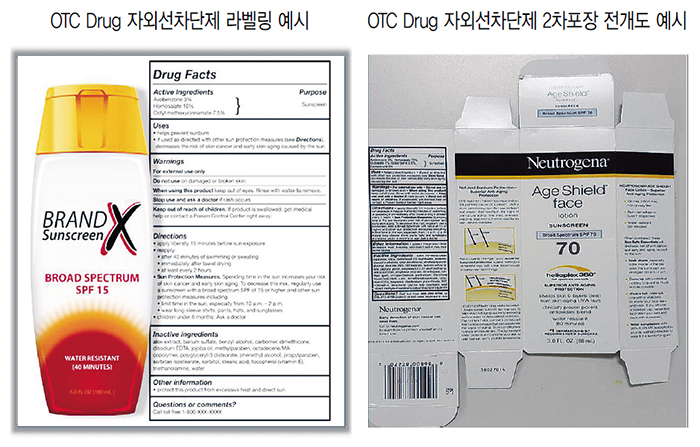
자외선차단제품, OTC 등록 필수
OTC(Over-the-Counter) Drug이란 미국에서 처방전 없이 일반 대중이 사용할 수 있는 안전하고 유효성 있는 일반의약품을 뜻한다.
현재 미국에선 약 800여개 중요한 유효성분을 포함해 10만여개의 OTC가 시판되고 있다. 이 중 국내에서 화장품으로 분류되는 자외선차단제(자외선차단지수 표기 모든 제품), 비듬 샴푸, 여드름 제품, Astringent 효과가 있는 Skin Protectant(Salicylic acid가 들어간 제품) 등이 화장품이 아닌 OTC로 분류된다.
미국에서 화장품인지 또는 OTC에 해당하는지를 판단할 때는 △Claim(표시광고)과 △Active pharmaceutical ingredient 함유 여부를 살펴보면 안다.
먼저 “broad spectrum sun protection”이라는 광고를 하고 있다면 이 제품은 자외선차단제 OTC에 해당하게 되며, 미백과 관련해 “Skin whitening” 또는 “Skin Bleaching”이라는 표현을 써도 OTC로 분류된다. 화장품에선 “Skin Brightening”이라는 표현만을 사용할 수 있다. 더불어 antibacterial 광고를 하는 손소독제(hand sanitizer) 역시 OTC로 분류된다.
다음으로 Active pharmaceutical ingredient 함유 여부를 잘 따져봐야 한다. 예를 들어 acne medication active ingredient를 일정량 함유하고 있다면, 제품 광고에서 acne를 언급하지 않더라도 OTC에 해당된다.
Monograph 준수, 사전승인 없이 등록
미국의 OTC 제도는 ‘OTC Drug Monograph’라는 일종의 레시피 북(Recipe book)에 따라 운영된다. 이 Monograph에는 일반적으로 안전하고 효능이 있다고 여겨지는 투약 조건(GRASE), 용량, 용법, 경고사항 등이 나열돼 있다. OTC Monograph를 따랐다면 사전 승인이 아닌 등록을 하게 되는 시스템으로 운영되고 있다.
만약 기존 Monograph를 따르고 싶지 않다면, NDA(New Drug Application : 신약평가절차)를 따라야 하는데 시간과 비용이 엄청나게 소요된다.
OTC Monograph에 가끔 TFM(Tentative Final Monograph)이라는 용어를 볼 수 있다. TFM 단계에선 Monograph가 언제든 변경될 수 있다는 것을 의미하기 때문에, TFM 아래에서 시판되는 OTC의 경우 라벨링,
GMP, 등록(registration)에 있어 Monograph 변경 여부를 민감하게 주시해야 한다.
FDA는 미국 내에서 사용되는 의약품을 제조하거나 재포장, 재라벨링하는 모든 설비(establishment)에 대해 FDA 등록을 요구한다. 이에 따라 OTC 등록절차는 △1단계 : Establishment Registration(공장 및 시설등록) △2단계 : NDC(국가 의약품 코드, National Drug Code) Relabeler Code 요청 △3단계 : Drug listing 순으로 진행된다.
주의할 것은 OTC 제품을 시장에 출시한 후 5일 이내에 등록(registration)을 완료해야 한다는 점이다. 통관 시 세관에서 OTC 제품 등록이 돼 있는지 확인하기 때문에 수입 OTC 제품을 미국 시장에 판매하기 위해서 사실상 판매 개시 전에 모든 절차가 완료돼 있어야 한다. 매해 등록 갱신은 10월 1일 ~ 12월 31일 사이에 하면 된다.
등록된 OTC 제품에 대해 FDA에서 인증서 같은 것을 발급하는 것은 아니지만, FDA 데이터베이스에 등록 정보가 저장돼 있으며, DailyMed( https://dailymed.nlm.nih.gov/dailymed/)라고 부르는 웹사이트에서 해당 정보를 일반인이 볼 수 있다.
FDA는 사후 감독 시 제품 라벨링에 있는 NDC(National Drug Code) 번호를 보고 DailyMed 사이트에서 검색해 이미 등록된 정보를 확인할 수 있다. 단, NDC 디렉토리에 수재됐다는 게 제조업자 및 시장에 출시된 제품에 대한 승인을 의미하는 것은 아니다.
이 사이트에서 볼 수 있는 주요 정보는 Active Ingredient(유효성분)을 비롯해 “PRINCIPAL DISPLAY PANEL”을 클릭하면 제품 포장전개도를 볼 수 있고, “INGREDIENTS AND APPEARANCE”를 클릭하면 유효성분명과 함량 정보, 포장단위, 제조업자 정보를 확인할 수 있다.
적색리스트 오르지 않게 주의해야
OTC 제품은 Drug facts panel에 별도 형식의 라벨링을 해야 한다. 표기해야 할 사항은 Active ingredients, Uses, Warnings, Directions, Inactive ingredients 등이다.
라벨링 규정을 잘 준수했다면 OTC의 경우 통관 시 문제가 발생하는 경우는 거의 없다.
하지만 화장품의 정의를 벗어나는 클레임을 할 경우에는 세관에서 잡힌다(holding). 통관 시 문제가 된 제품에 대해 FDA에서는 Import Alert(수입 경보)를 주고 FDA 사이트에 공개한다.
이 사이트(www.accessdata.fda.gov/cms_ia/importalert_190.html)에 들어가면 국가별, 회사별로 Import Alert를 받은 회사의 문제가 된 제품의 제품명과 위반사유를 알 수 있다.
Import Alert은 yellow-green-red로 나뉘는데, 적색리스트(Red List)는 특정 회사의 제품이 현재 관련법을 위반했고 미래에도 위반할 확률이 높다고 판단할 때 적용되는 적색리스트(Red List)에 오르면 통관이 매우 어려워진다.
특히 괘씸죄에 걸리지 않게 주의해야 한다. 한국 업체들 중 통관 시 문제가 발생했을 때 급한 마음에 다른 수입자를 통해서 물건을 미국에 들이려는 경우가 있는데, 문제를 해결하지 않은 상태에서 그렇게 진행할 경우 미국 세관의 괘씸죄에 걸려 더 나쁜 결과를 초래한다.
제품에 전혀 문제가 없는데 어느 날 갑자기 수입 통관이 거절되는 경우가 생길 수 있다. 이는 어떤 제품이 수입 불허된 경우 동일 해외제조소 생산제품에 대해 모두 수입 불허를 시킬 수 있기 때문이다.
김경옥 대한화장품협회 국제협력팀장은 “미국 세관에서 제품을 holding할 경우 성실히 응하고 문제를 해결하려는 노력을 해야 한다”며 “세관에서 잡으면, 세관은 FDA에 이 정보를 공유하게 되고 FDA에서 해당 화장품 회사로 연락을 하는데 이때 빠르고 공손하게 ‘미국 법규를 잘 이해를 하지 못했다. 어떻게 하면 될까요?’라고 회신하는 게 상책”이라고 조언했다.
의약품 GMP 수준으로 제조소 감사
OTC Drug에서 간과하지 말아야 할 사항 중 하나가 제약(pharmaceutical)처럼 다뤄진다는 것이다. 이에 FDA는 제조소를 감사(inspection)할 때 제약 기준(pharmaceutical standard)으로 본다. 미국 시장에 진출한 한국 업체들이 어려움을 겪고 있는 이유다.
해외 제조업자가 가장 많이 하는 실수는 FDA 감사를 받은 뒤 FDA가 지적한 사항을 무시(ignore)해 버리는 것인데, 그렇게 하면 적색리스트에 올라가 수입 시 통관이 거부돼 미국 시장에서 더 이상 물건을 팔 수 가 없게 된다.
FDA가 감사를 끝내면 지적사항에 대해 업체가 회신할 기간을 15영업일 정도를 주는데 이 기간내에 모든 것을 완료하라는 의미는 아니다. 앞으로 어떻게 할 것인지에 대한 시정 계획을 수립해 15일 이내에 FDA에 회신하면 된다. 이 과정에서 가장 중요한 것은 회신을 보내는 것이다. FDA와 커뮤니케이션을 하는 게 핵심이라는 걸 명심해야 한다.
사소한 사안의 경우 FDA에서 준 기한이 지났는데도 업체에서 회신이 없다면 보통 FDA가 다시 연락해온다.
하지만 안전성과 관련된 부분에 대해 지적을 받은 경우 15일 이내에 아무런 회신을 하지 않는다면, 해당 제조소에서 생산된 제품의 수입을 FDA가 막을 수도 있다.
FDA를 만족시키면서 회사에서 감당할 수 있는 수준으로, 시정 계획을 세워서 FDA에 회신하는 것이 매우 중요하다.
FDA는 감사 후 “맞다/틀리다(that’s right or not)”가 아니라 “충분하다/충분하지 않다(that’s sufficient or not sufficient)”라고 이야기한다. 충분하지 않다는 평가를 받으면, 회신기간 내에 적절한 시정 계획을 세워서 답을 보내면 된다. 시정계획 제출 후 약속한 시일이 지나면 FDA가 두 번째 감사를 나와 시정계획 준수 여부를 확인한다.
FDA 감사에는 2가지 유형이 있다. 첫 번째는 “surveillance inspection”으로 FDA에 제조소가 등록되면 통상적으로 1~2년에 한번씩 나오는 유형이다. 통상적으로 제조소 등록 6개월 이내에 나온다. 특이한 점은 해외제조소의 경우 거의 감사가 없다가 최근 4년간 모든 해외제조소가 감사를 받았다.
수입 제품은 통관 보류/중지한 경우 FDA에서 해외제조소에 대한 감사를 나가게 된다. 해외제조소는 그 특성상 사전에 미리 연락을 주고 나오기 때문에 대비할 시간적 여유가 있다. 해외제조소에 대한 감사 기간은 업체당 약 5일 정도다.
두 번째 유형은 뭔가 의심스럽거나 잘못된 경우 나가는 “for-cause inspection”이다. 경쟁사가 FDA에 “저 제품이 문제가 있는 것 같은데, 나가서 한번 보셔야 할 것 같다”고 고자질 하는 경우도 있고, 소비자 컴플레인(심각한 부작용 등)으로 인해 나가게 되는 경우도 있다.
안전성 지적시 기일내 반드시 회신해야
FDA는 감사 후 수집한 문제가 발생하거나, 시장에서 recall이 있거나, 특이사항보고 등의 문제가 발생할 경우 ‘Warning letter’로 시작해서 ‘회수(Recall)’ → ‘압류(Seizure)’ → ‘소송(civil or criminal law suit) 순으로 조치를 취한다.
첫 번째 조치인 Warning letter는 발견된 문제에 대한 의사소통을 위해 발행하는 비공식적 수단으로, FDA가 처벌 조치를 취하는 것과는 무관하다. 일종의 public information 이라고 보면 되는데, FDA 웹사이트에 올라가며, 회사명과 무엇을 잘못했는지에 대한 정보가 공개된다.
업체가 Warning letter을 받게 되면 제품 포장, 광고 문구, 웹사이트 등에 사용된 과대표현을 수정해야 한다.
Warning letter를 받은 제조소에서 제조한 제품에 대해서는 통관지체(detention) 및 통관 불허로 이어질 수 있어 주의를 요한다.
김경옥 팀장은 “화장품의 효능 효과를 벗어나는 “prevent/repair scalp”, “scalp therapy”, “dandruff”, “Skin whitening”, “broad spectrum sun protection” 등의 표현을 사용하는 경우 Warning letter를 받게 되므로 주의해야 한다”고 지적했다. 그러면서 “미국은 사전에 규제하고 감시하기보다 문제가 터졌을 때 강력하게 처벌하는 시스템이어서 규제당국(FDA)과의 의사소통이 매우 중요하다. 어떤 경우라도 정직하고 성실하게 커뮤니케이션을 할 수 있도록 해야 한다”고 조언했다.







.gif)


 올해 뷰티 트렌드는 ‘6S’ … 뷰티테크·클린뷰티 고성장 전망
올해 뷰티 트렌드는 ‘6S’ … 뷰티테크·클린뷰티 고성장 전망 일본 소비자 사로잡은 바닐라코만의 핑크빛 화사함
일본 소비자 사로잡은 바닐라코만의 핑크빛 화사함 화해쇼핑 출범 6주년, 누적 거래액 1600억 돌파
화해쇼핑 출범 6주년, 누적 거래액 1600억 돌파 한국콜마, 업계 최초 ‘고삼추출물’ 탈모 완화 효능 발견
한국콜마, 업계 최초 ‘고삼추출물’ 탈모 완화 효능 발견 [동정] ‘아모레퍼시픽 서성환 100년’ 리미티드 에디션
[동정] ‘아모레퍼시픽 서성환 100년’ 리미티드 에디션 가장 혁신적인 국내 뷰티 제품 ‘노라이 왁싱 패치’
가장 혁신적인 국내 뷰티 제품 ‘노라이 왁싱 패치’ 용산 드래곤즈, 서울시·용산구와 매력정원 조성
용산 드래곤즈, 서울시·용산구와 매력정원 조성 센텔리안24 마데카 프라임 인피니티X김호영
센텔리안24 마데카 프라임 인피니티X김호영 이투바이오, 키르기스스탄 중앙아시아 진출 발판 마련
이투바이오, 키르기스스탄 중앙아시아 진출 발판 마련 LG생활건강 더후, 중국 징둥닷컴 ‘스타어워즈’ 수상
LG생활건강 더후, 중국 징둥닷컴 ‘스타어워즈’ 수상





